碳氢键活化研究近期论文速览
更新日期:2015-10-081. 《Science》发表选择性活化醇上C-H键新方法
近年来,C-H键活化成为了一个非常活跃的方向,经常被用来构建和扩展分子骨架,或对复杂大型分子进行后期修饰。
C-H键在有机化合物分子中极为常见,在不同位置上的C-H键都有可能被活化,这就为控制反应的选择性带来了挑战。更有挑战性的是,如果目标C-H键的强度比其它非目标C-H键还要高,比如其位于醇类分子羟基的邻位的位置,这就难上加难了。事实上,这也是几十年来有机合成界一直想要实现的目标。
在C-H活化方面颇有建树的美国普林斯顿大学的有机合成化学家David MacMillan实验室,最近又在《科学》上发文(Science, 2015, DOI: 10.1126/science.aac8555),提出了一种新的选择性活化羟基邻位C-H键的策略。他们利用一种可形成氢键的催化剂四正丁基铵磷酸(TBAP)与羟基作用,减弱其邻位C-H键的强度,并用另外两种催化剂——氢原子转移(HAT)催化剂和基于铱元素的光致氧化还原催化剂来帮助有选择性地完成该邻位C-H的活化反应。这三种催化剂的协同作用使新的C-C键精准地发生在该羟基的邻位,而不是其它C-H位置。
更为可贵的是,MacMillan实验室的研究人员通过系统的机理分析而提出这样的一种合成方法思路,并通过同位素取代实验和反应动力学分析等手段令人信服地验证了此催化反应机理。他们也在此过程中优化了催化剂的性能。
(来源:http://www.x-mol.com/news/1058)
2. 《Science》:光催化芳烃C-H氨基化反应
向芳环添加氮原子的常用技术一般需要C-H键首先被官能化(在芳环上添加卤素、三氟甲磺酸和硼酸等基团),这导致整个过程步骤复杂、反应效率低、成本高、废物多。近年来,过渡金属催化的C-H键活化已经可以不需预官能化就能在芳环上添加C-C键、C-O键以及C-N键,但这种方法目前受到很多限制,缺乏通用而又实际有效的芳环胺化途径。具体来说又有以下几个挑战:(1)区域选择性添加胺化取代基;(2)使含氮合成前体不只局限于酰胺和酰亚胺;(3)简化原料分子结构,实现温和的合成条件。
美国北卡罗来纳大学教堂山分校的David A. Nicewicz研究团队,采用一种通用的芳环C-H键功能化的策略,用之进行了芳烃的位点特异性胺化反应。相关研究成果发表在《科学》杂志上(Science, 2015, DOI: 10.1126/science.aac9895)。
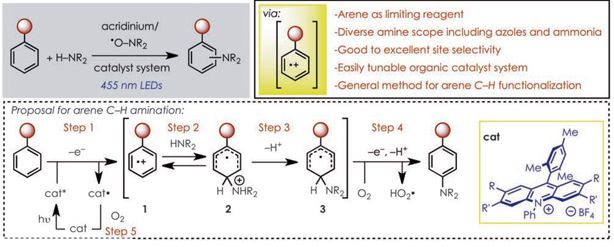
图来源:Science 杂志
这种策略使用了一种光氧化还原催化系统(包括吖啶光氧化剂和硝酰自由基)促成一系列芳烃与含氮杂芳环连接,得到在药物研发中很有潜力的各种芳环胺化产物。该团队还描述了用氨或简单的铵盐形成苯胺的反应过程,而无需对芳香族原料进行预功能化。
这种方法中最核心的催化剂是一类能吸收蓝色光的吖啶离子,以激活芳环上的碳与含氮化合物反应。然后,甲硝酰自由基助催化剂(2,2,6,6-tetramethylpiperidine-1-oxyl, TEMPO)又将碳上的氢原子转移到氧原子上。整个反应收率高,底物范围广泛,条件温和。
(来源:http://www.x-mol.com/news/1022)
3. 南京大学sp3 C-H键官能团化研究获新进展
碳氢键的直接官能团化是当今化学领域最为活跃的课题之一,而其中烷基的C–H的直接官能团化最为困难和富有挑战。最近,南京大学化学化工学院史壮志教授课题组在sp3 C-H直接官能团化反应方面取得系列重要进展。
(1)让sp3 C-H官能团化实现“手性记忆”功能(J. Am. Chem. Soc., 2015, 137, 7564):分子内C-H胺化合成含氮杂环是一种原子经济性的方法,已广泛应用于生物碱和药物的合成,但传统的分子内的胺化反应往往存在反应条件苛刻等缺陷。该课题组利用芳基碘化物作为催化剂,实现了苄位的C-H的胺化反应。最重要是,该体系解决了C-H官能团化中立体专一性的难题,使具有手性的C-H键位点通过反应可以快速、高效地保留在产物当中,实现了“手性记忆”功能。
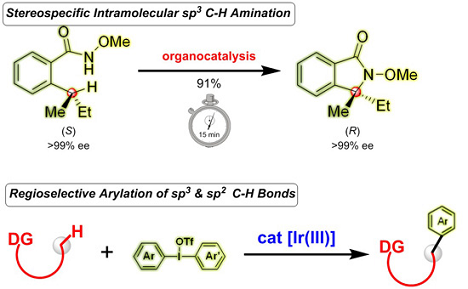
上图来源:J. Am. Chem. Soc., 2015, 137, 7564,下图来源:J. Am. Chem. Soc., DOI: 10.1021/jacs.5b06758
(2)首次实现烷基肟醚的C-H芳基化反应(J. Am. Chem. Soc., 2015, DOI: 10.1021/jacs.5b06758):该课题组利用三价铱金属配合物作为催化剂,芳基高碘化物作为芳基源,首次成功实现了肟醚β位C-H键的直接芳基化反应。该体系兼容性非常高,除了烷基的C-H芳基化外,各种芳基以及烯基的C-H键均能实现活化,解决了过去一种催化体系只能适用一种底物类型的难题。
以上两类反应,均通过密度泛函理论(DFT)计算,从理论的角度解释了反应的形成过程,该部分工作是通过和美国加利福尼亚大学洛杉矶分校K. N. Houk教授和温州大学夏远志教授合作分别完成。
(来源:南京大学化学化工学院)
4. 大化所在铑催化碳氢键活化领域取得系列进展
含有碳氢键的化合物几乎无处不在,是理想的反应原料。由于碳氢键活性低,通常需要金属催化剂来活化。近几年该方面的研究工作表明,茂基三价铑催化剂对碳氢键活化有着独特的活性、选择性以及官能团兼容性。尽管如此,由于底物和反应的多样性,仍然需要对底物进行活化。中科院大连化学物理研究所金属络合物与分子活化研究组(209组)在这一领域取得了一系列进展,并在美国化学会《化学研究评述》期刊上发表综述(Acc. Chem. Res., 2015, 48, 1007)。近期取得的代表性进展如下:
(1) 芳烃底物的活化
芳烃碳氢键和金属催化剂作用产出的金属-碳键(M-C)活性中间体是亲核性的,因此只能和亲电试剂电性匹配,发生偶联。为了克服这一局限,该研究组之前采用的策略是对偶联试剂进行极性反转,将其原位转化为亲电试剂(J. Am. Chem. Soc. 2014, 136, 4780; Org. Lett. 2015, 17, 920.)。为了拓宽极性反转的概念,进一步提出了将芳烃进行极性反转的新思路,即将亲核性的Cδ--H键经铑催化转化为亲电、高活性、稳定的高价碘试剂Cδ+-I(III), 从而达到和一系列亲核试剂偶联的目的;利用这一策略实现了芳烃碳氢键在氮原子定位作用下和简单的高价碘原料(Koser试剂)之间的高价碘化反应,得到非对称的二芳基高价碘。基于二芳基高价碘的亲电活性,可以经铜催化简便地和一系列C、N、O、P、S、Br等亲核试剂发生选择性的(亲核)官能化。该反应的优点是,对于这些形成不同的碳-碳、碳-杂原子键的反应,无需逐一经过C-H键活/官能化反应来对每一个反应进优化,因此具有发散合成的优势。这一工作发表在《德国应用化学》上(Angew. Chem. Int. Ed., 2015, 54, 7405)。

(2) sp3 C-H键的活化
铑催化碳氢键活化体系中绝大多数底物局限于芳烃和烯烃(sp2 C-H),而烷烃的碳氮键由于下列原因通常活性很低: (1) C(sp3)-H键的位阻较大;(2) 形成的Rh-C(sp3)中间体的活性低,和偶联组分作用较为困难; (3) 形成的Rh-C(sp3)中间体可能发生b-氢消除等不利反应。正因如此,三价铑催化下C(sp3)-H键官能化的报道仅有数例。因此利用烷烃中C-H键作为原料来快速构建C-N键有重要意义。该研究组利用稳定而有高活性的杂环作为酰胺化试剂,在三价铑催化下实现了一系列甲基和亚甲基碳氢键的选择性酰胺化。该反应具有条件温和、选择性高、底物范围广、官能团兼容性好等优点,同时也适用于天然产物的后期官能化。反应经历了碳氢键活化、酰胺化试剂的脱二氧化碳产生nitrene 中间体、以及铑碳键对nitrene的插入等过程。初步结果表明,羧酸银盐添加剂既能辅助碳氢键活化,也有助于酰胺化试剂的活化。这一工作近期发表在《德国应用化学》(Angew. Chem. Int. Ed. 2015, 54, DOI: 10.1002/anie.201506323)上。
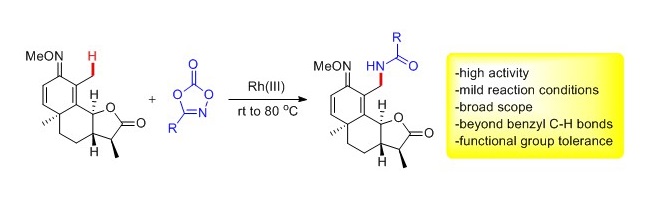
(来源:中科院大连化学物理研究所)
5. 郑州大学在碳氢键活化研究中取得新进展
郑州大学化学与分子工程学院宋毛平教授研究团队在廉价金属钴(II)催化的芳烃C(sp2)-H键与端基炔C(sp)-H键的C-C/C-N串联偶联反应中再次取得重要进展。相关研究成果近日发表于《德国应用化学》(Angew. Chem. Int. Ed., 2015, 54, 10012-10015)上。
含氮杂环化合物广泛存在于各类药物分子中,因此高效和高选择性地合成含氮杂环骨架受到有机合成化学家们的广泛关注。其中,如何高选择性地合成3-位亚甲基取代的异吲哚啉-1-酮杂环分子,是该领域研究的难点之一。已报道的研究通常需要预先官能化的原料或者多步反应来实现3-亚甲基异吲哚啉-1-酮的合成,但步骤相对繁琐,原子经济性差。更为直接的方法是通过金属催化的苯甲酰胺衍生物与炔烃的偶联反应,然而反应的区域选择性很难控制,通常得到的是异喹啉酮化合物。
近期,宋毛平团队利用该团队开发的N,O-双齿导向基,致力于发展廉价金属催化C-H键活化的新方法和新策略,已经成功实现了首例钴(II)催化芳烃/烯烃C-H键的烷氧基化反应(Angew. Chem. Int. Ed., 2015, 54, 272-275),铜促进的直接烷氧基化和芳氧基化反应(Org. Lett.2014, 16, 1104-1107;J. Org. Chem.2014, 79, 10399-10409)。为了进一步开发廉价金属钴在有机合成中的应用,研究团队继续做了系统深入的研究。该项研究通过“N,O-双齿螯合导向”的策略,以较低的催化剂用量(5 mol%草酸钴),实现了芳烃和炔烃C-H键的活化及化学转化,成功地完成了3-亚甲基异吲哚啉-1-酮的简捷合成,反应具有高度专一选择性。该研究为进一步构建和发展其它钴催化C-H键直接官能团化反应提供了新的思路。
(来源:郑州大学)
6. 北大利用连续C-H活化策略实现复杂天然产物高效全合成
北京大学化学学院雷晓光课题组在《美国化学会志》杂志上报道了通过连续C-H键活化策略实现复杂天然产物(−)-Incarviatone A的首次不对称全合成(J. Am. Chem. Soc., 2015, DOI: 10.1021/jacs.5b08551)。
C-H键活化反应是目前有机合成化学的重要研究方向。如何利用C-H键活化反应合成具有多官能团和复杂结构的分子,特别是天然产物分子,一直是该研究领域亟待解决的重要科学问题。雷晓光课题组一直致力于开展活性天然产物高效全合成与后继化学生物学研究。他们选取了从传统中药红波罗花中提取出来的一个具有结构复杂的天然产物(−)-Incarviatone A最为研究对象。该天然产物具有新颖的多环骨架和8个连续的手性中心,其中包括3个连续的季碳中心。更重要的是,初步生物活性实验显示,该天然产物对单胺氧化酶具有非常好的抑制效果(IC50 29nM),因此,该化合物对抑郁症,阿尔兹海默症和其他的神经系统疾病具有潜在的治疗效果。由于该天然产物的自然来源非常有限,实现其高效全合成对于开展后续的生物作用机制与创新药物研究具有重要推进作用。
在该天然产物的全合成探索中,雷晓光课题组提出了一个连续的、可放大量的C-H活化策略,以商业可得的苯乙酸为起始原料,通过4次高效、选择性的C-H活化反应,其中包括首次发展的不对称sp3 C-H插入反应高效合成手性indane骨架等,合成了关键的手性二醛中间体。在后期,研究人员还运用了仿生合成策略,通过高效的串联反应,一步完成了天然产物的制备,最终以14步完成了(−)-Incarviatone A的首次不对称全合成。美国《化学与工程新闻》(Chemical &Engineering News)对该全合成研究进行了新闻报道,指出该工作为复杂分子的高效合成提供了新的思路。
(来源:北京大学化学与分子工程学院)