基于“瞬间稳态”的不对称质子迁移策略制备β-手性酰胺
更新日期:2018-05-09酰胺是合成化学中的核心官能团,它不但能够介导多样性杂环骨架的构建,亦广泛存在于生物活性分子及药物骨架中。其中,利用手性酰胺片段修饰的多肽可以降低其极性,提高代谢稳定性及穿膜性,成为一类重要的天然氨基酸残基替代单元。β-手性酰胺化合物通常通过强还原性条件制备:有机金属试剂的不对称迈克尔加成,或是不饱和酰胺的不对称氢化反应,对含有金属配位能力的杂原子底物的反应适用性低。
北京大学深圳研究生院黄湧课题组致力于发展仿生质子迁移策略,通过对“最小亲电试剂”——质子的精准时空调控,发展高效手性片段的合成。此前,该课题组基于这一思路,发展了基于质子迁移催化的首个氮杂卡宾“非共价催化模型”,成功实现了碳-碳、碳-硫及碳-氮键的不对称构建(Nat. Commun. 2014, 5, 3437; Chem. Sci. 2015, 6, 4184; Angew. Chem. Int. Ed. 2015, 54, 15414)。在此基础上,研究小组进一步发展了不对称β-质子化反应,实现了烯醛的不对称氢酯化反应(J. Am. Chem. Soc. 2017, 139, 7045; Chem. Commun. 2018, 54, 1473)。近日,研究团队为了解决碱性胺对质子迁移的干扰问题,设计了“瞬间稳态酰胺中间体”(transient acyl trap),发展了基于氮杂卡宾催化的仿生不对称质子迁移,高效构建了β-酰胺等一系列手性羧酸衍生物,成果近日在线发表于《德国应用化学》,题为“Enantioselective hydroamidation of enals by trapping of a transient acyl species”(Angew. Chem. Int. Ed. 2018, DOI: 10.1002/anie.201803556)。
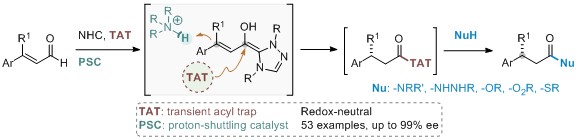
“瞬间稳态”的不对称质子迁移策制备β-手性羰基化合物
为了同时获得高不对称β-质子化和具有一定稳定性的活性酰基中间体,反应体系对“瞬间稳态”试剂的酸性和亲核性有着严格的要求。通过系统的反应变量研究,研究小组发现,以氨基茚醇衍生的三氮唑为卡宾前体,桥头胺盐为质子梭,咪唑(或者咔唑)为“瞬间稳态”试剂,能够获得具有高度光学活性的β-手性酰基“稳态”中间体,并可以被脂肪胺、芳香胺、肼、酰肼、醇、过氧醇、酚、水及硫醇等一系列亲核试剂原位捕获,生成广泛的β-手性羧酸衍生物。这些产物可以迅速构建手性杂环片段,并对多肽进行N端修饰。
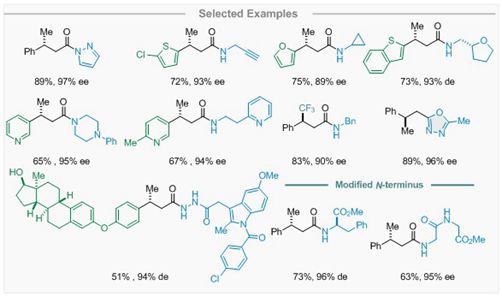
氮杂卡宾介导的不对称氢化酰胺化
(来源:北京大学新闻网)