Nature Chem.封面:Mn催化分子间苄基C(sp3)-H键的胺化反应
更新日期:2018-06-05在天然产物或生物活性分子中引入氮原子可以极大地改变分子的物化性质及生物学活性,一个著名的例子就是首个广谱抗菌的青霉素衍生物氨苄西林(ampicillin)。与主要抑制革兰氏阳性菌的青霉素(penicillin G)不同,结构中包括苄胺结构的氨苄西林可以同时抑制革兰氏阳性菌和革兰氏阴性菌。以往合成此类化合物的方法主要通过预先构建C-X键(X = 氧、卤素等),实现预官能化后进行转化,但对于复杂分子的后期修饰来说就显得十分不便。因此,发展将C-H键直接转化为C-N键的方法具有十分重要的意义。在过去的研究中,铑催化的氮宾插入过程可以实现分子内的C-H键胺化反应。该方法同样适用于分子间的苄位、三级和烯丙位C-H键的胺化过程。然而,对于分子间的胺化反应,尤其是存在多个反应位点如苄位和三级C-H键时,反应往往会形成较难分离的混合物。此外,氨基和芳香杂环修饰的底物的远程C-H键胺化尚无报道。近年来,廉价金属在实现高选择性的分子内C-H键胺化中开始发挥重要的作用,然而分子间胺化的报道却较少。如Co催化分子间苄位C-H键的胺化需要溶剂量的底物,同时,该过程不能对存在电性差别的分子间C-H键进行有效区分。Fe和Mn催化的分子间C-H键叠氮化反应对含氮杂环具有较好的兼容性,但是这些基于自由基途径的过程往往会带来较差的区域选择性(图1)。
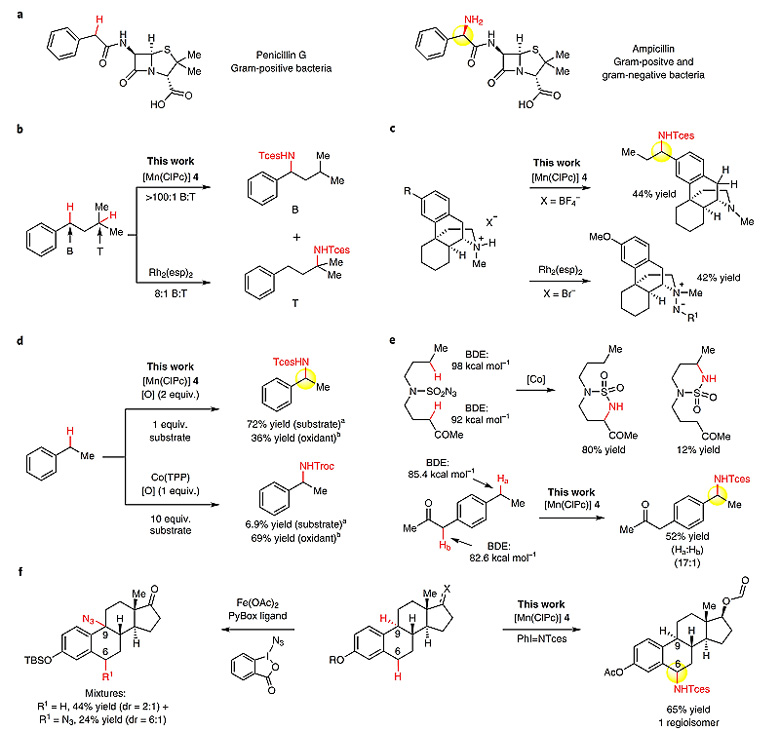
图1. C-H键活化构建C-N键。图片来源:Nat. Chem.
近期,美国伊利诺伊大学厄巴纳-香槟分校(UIUC)的Christina White教授团队报道了以多氯酞菁锰[MnIII(ClPc)]作为催化剂实现高选择性分子间苄位C(sp3)-H键胺化反应的工作。他们利用该方法同样可以实现天然产物和生物活性分子的后期修饰,反应对其他含氮官能团如三级胺、吡啶和苯并咪唑等都具有很好的兼容性(图1)。相关工作“Manganese-catalysed benzylic C(sp3)–H amination for late-stage functionalization”发表在上(Nat. Chem., 2018, 10, 583–591, DOI: 10.1038/s41557-018-0020-0),并被选为封面文章(图2)。

图2. 六月刊封面。图片来源:Nat. Chem.
作者以乙酸苯丙酯1作为模板底物,对一系列以往用于分子内C-H键胺化反应的第四周期过渡金属催化剂进行考察,发现当使用多氯酞菁锰[MnIII(ClPc)] 4(4 = [MnIII(Cl16Pc)]SbF6,图4a)作为催化剂、PhI = NTces作为胺化试剂时,分子间的C-H键胺化反应能够顺利地进行。反应中非配位的SbF6-阴离子对于提高过渡金属阳离子的亲电活性具有重要的作用,吸电子特性的配体可辅助亲电性的金属氮宾形成,从而实现分子间的C-H键胺化。最终他们以苯作为溶剂,并加入5 ?分子筛作为添加剂,反应在40 ℃的条件下进行,以68%的产率得到苄位氨基化的产物。
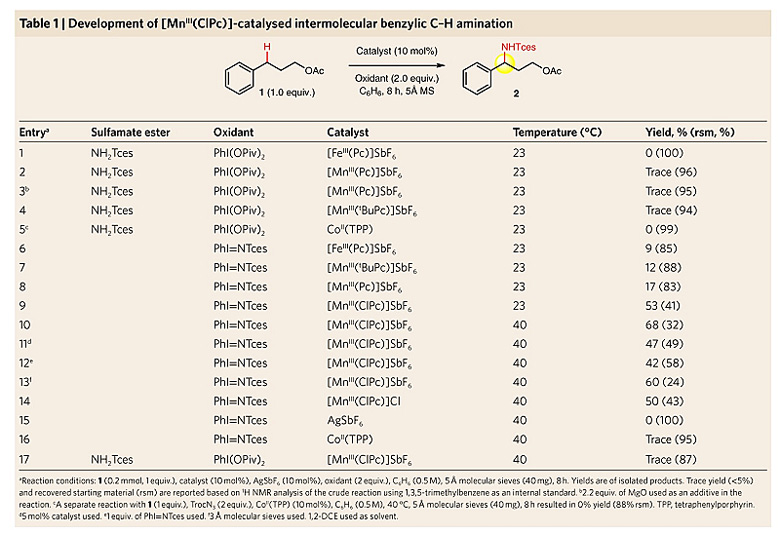
图3. 反应条件的优化。图片来源:Nat. Chem.
在最佳条件下,作者对分子间苄位C-H键胺化反应的底物适用范围进行了考察。不同的官能团如甲氧基、溴、酯基、酰胺等都能较好地兼容。同时,作者还利用质子化保护的策略对四种含氮药物分子的反应情况进行考察,发现分子中包含三级氨基、吡啶基团、一级氨基的底物也能高效地参与反应。
为了证明该方法的实用性,作者还将其应用到一系列生物活性分子如FKGK11、维甲酸受体激动剂等类似物的后期官能化反应中,并取得了非常好的反应效果。
——总结——
Christina White教授团队报道了多氯酞菁锰[MnIII(ClPc)]催化分子间高选择性的苄位C(sp3)-H键胺化反应。锰催化剂4可通过廉价易得的原料,以一步反应大量合成。该反应具有良好的官能团兼容性,底物中修饰其他含氮官能团如三级胺、吡啶和苯并咪唑等也可以顺利地参与反应,对实现复杂天然产物分子及生物活性分子的后期C-H键胺化具有重要的意义。
(摘自X-MOL平台)